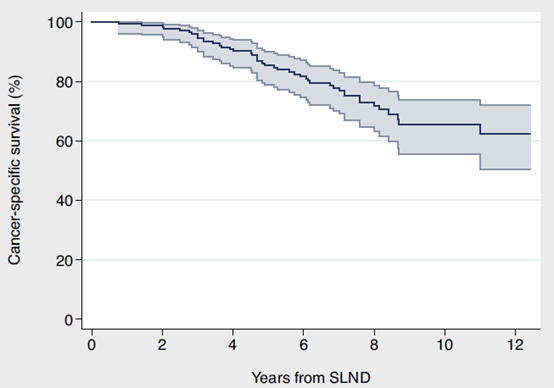
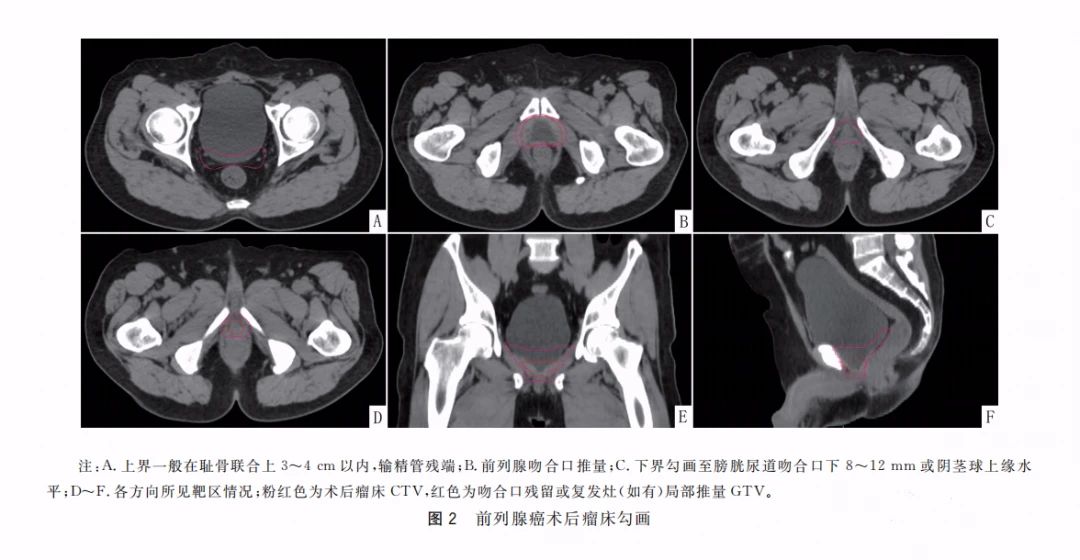
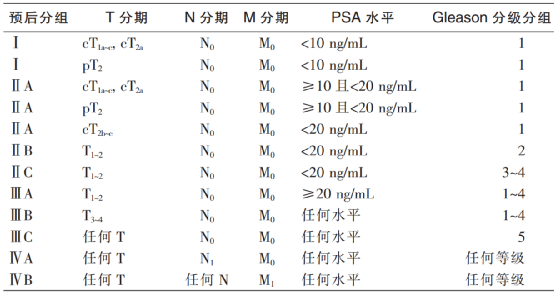
作者 中华医学会泌尿外科学分会 中国前列腺癌研究协作组(CPCC) 引用本刊 中华医学会泌尿外科学分会,中国前列腺癌研究协作组(CPCC). 根治性前列腺切除术后生化复发的高危患者诊治共识(2024年版)[J].中华泌尿外科杂志,2024,45(6):409-415. DOI:10.3760/cma.j.cn112330-20240517-00234 通信作者 叶定伟 Email:dwyeli@163.com 根据最新数据,世界范围内前列腺癌发病率居男性恶性肿瘤第2位,癌症特异性病死率居第5位[1]。根治性前列腺切除术是治疗局限期前列腺癌的标准治疗方案,目标是根除肿瘤的同时尽可能保持盆底各组织和器官功能[2]。尽管根治性前列腺切除术经历了开放到腹腔镜再到机器人辅助腹腔镜的演变,手术技巧逐渐完善成熟,但仍有部分患者会在根治术后发生生化复发(biochemical recurrence,BCR),其中的高危患者如未得到及时诊治会很快进展到临床复发,进而对患者的生命造成威胁[3]。 尽管前列腺特异性抗原(prostate specific antigen,PSA)监测依然是早期发现BCR的重要手段,但随着影像学进步和新型抗雄激素药物的出现,以及立体定向放疗的发展,根治性前列腺切除术后BCR高危患者的诊治理念和手段都有了较大改变。因此,我们召集该领域的相关专家,通过查阅文献,针对根治性前列腺切除术后BCR的诊断、治疗、随访和疗效评估进行探讨,并形成一系列共识,旨在为临床医生处理此类疾病提供指导意见。 一、共识的制订方法 (一)制订共识的专家构成 42名来自上海、北京、广东、山东、江苏、四川、重庆、河南、湖北、江西、辽宁、天津、吉林、浙江、新疆、黑龙江、陕西、云南、湖南、山西、河北、广西、安徽、贵州、福建、甘肃等26个省、自治区、直辖市的中国前列腺癌研究协作组(Chinese Prostate Cancer Consortium,CPCC)专家共同参与问卷咨询与调研,所有专家均有三级甲等医院泌尿外科一线临床实践经验。 (二)文献检索方法 检索的英文数据库包括Pubmed、Web of Science和Cochrane Library,中文数据库包括中国知网、万方数据库、维普数据库和中国生物医学文献数据库。检索时间为建库至2024年2月。英文检索词包括prostate cancer、biochemical recurrence、high risk、radical prostatectomy、curative treatment、management、evaluation、salvage treatment、follow up、radiotherapy、hormone therapy; 中文检索词包括前列腺癌、生化复发、高危患者、根治性前列腺切除术、根治性治疗、诊治手段、疗效评估、挽救性治疗、随访、放疗和内分泌治疗。纳入的文献类型包括系统综述、Meta分析、随机对照临床研究、队列研究、病例对照研究和病例报告等,以及与前列腺癌术后BCR相关的指南、共识和综述。排除重复文献、非中英文文献、学位论文、索引、无法获得全文的文献。经文献检索、筛选和证据汇总后,开始编写初步草稿。 (三)德尔菲问卷调查 本共识采用德尔菲问卷调查法针对根治性前列腺切除术后BCR的诊治手段进行专家函询。投票设置“非常同意”“基本同意”“不确定或不同意”3个选项,专家可对每个章节提出修改意见。每次调查结束,根据反馈意见对共识稿件进行修改。若同意率(选择“非常同意”或“基本同意”的专家人数比例)≥75%则认为该章节达成共识。 (四)证据分级方法。 本共识对证据和共识的分类采用GRADE系统[4-5](表1)。 (一)问卷收集情况 共开展2次问卷调查,43名专家参与问卷填写,收集了24条专家建议。汇总分析2次问卷数据,基于审核专家的一致意见,最终纳入均达成共识的条目,经审核和部分修改后定稿。 (二)共识达成情况 1.根治性前列腺切除术后BCR的定义 (1)概述 根治性前列腺切除术后2个月PSA会降至检测水平以下,即PSA<0.1 ng/ml[6]。27%~53%的根治性前列腺切除术后患者会发生PSA升高,当PSA达到某一特定的阈值后(该阈值尚有争论),可被定义为BCR。尽管PSA升高或BCR往往预示着疾病会进展或发生转移,但有时PSA升高的过程也可能很漫长,也不是每例PSA升高的患者都会发生肿瘤的临床复发并危及患者生命。因此,BCR并不能完全预测总生存情况[7]。临床医生处理BCR时会面临一方面需要延长患者发生转移和生存时间,一方面需避免过度治疗影响患者生活质量的困境。因此对于此类患者的治疗推荐多学科讨论。 (2)根治术后BCR的不同定义标准 既往指南将BCR定义为根治性前列腺切除术后检测不到PSA,但随后≥2次检测到PSA升高且升高的阈值达到PSA>0.2 ng/ml[8-9]。2024年NCCN指南将根治性前列腺切除术后PSA降至检测水平以下,随后2次检测PSA>0.1 ng/ml作为BCR最新的标准[10]。如果将标准定为根治性前列腺切除术后PSA>0.4 ng/ml与患者发生远处转移更一致,且后续PSA不太可能回落[11-12],但可能错过早期干预提高疗效的机会。 (3)BCR高危患者的定义 PSA速率指每年血清PSA上升的绝对值,单位为ng/(ml·年)。PSA倍增时间(PSA doubling time,PSA-DT)指血清PSA翻倍所需要的时间。EAU对BCR高危患者的定义为PSA-DT<1年或国际泌尿病理协会(International Society of Urological Pathology,ISUP)评分4~5分的患者[13]。根据EMBARK研究[14],以根治术后PSA>1 ng/ml且PSA-DT<9个月定义为BCR高危患者,且使用二代抗雄激素药物可以得到更多临床获益,目的是及早干预。 专家推荐:①BCR的定义为根治性前列腺切除术后PSA降至检测水平以下,随后≥2次检测到PSA升高且升高的阈值达到PSA>0.1 ng/ml。②为及早干预治疗,前列腺癌BCR高危人群的定义为根治术后PSA>1 ng/ml且PSA-DT<9个月。 2.根治术后BCR的影像学检测方法 (1)传统影像学检测方法 传统影像学检查包括MRI、CT、骨扫描(emission computed tomography,ECT)等。对于前列腺窝的局部复发情况可应用MRI检查,MRI阳性的PSA临界值为0.3~0.5 ng/ml;PSA动力学也有一定影响[15]。CT、ECT检查在评估全身转移灶方面有一定价值,但阳性率较低。在根治性前列腺切除术后BCR患者中,当PSA<7 ng/ml时,骨扫描阳性率<5%[16]。在一项纳入132例根治性前列腺切除术后BCR患者的研究中,CT阳性患者的PSA平均水平为27.4 ng/ml,PSA速率为1.8 ng/(ml·月)[17]。 (2)新型影像学检测方法 由于PSMA PET/CT检查的敏感性、特异性较高,推荐BCR高危患者行PSMA PET/CT检查。一项回顾性研究结果显示,不同PSA水平下,68Ga-PMSA PET检查的阳性比例不同,当PSA为<0.20、0.20~0.49、0.50~1.00、1.00~2.00、>2.00 ng/ml时,阳性率分别为33%、45%、59%、75%、95%,68Ga-PMSA PET诊断前列腺癌的敏感性为75%,特异性为99%[18]。 另一项前瞻性研究评估了18F-DCFPyL对208例BCR患者的诊断效能,证实了18F-DCFPyL-PSMA PET对BCR患者病灶精准定位的重要性[19]。但目前尚缺乏两种示踪剂之间的对照研究。即便PSA水平较低,通过PSMA PET/CT检查仍可以发现有很大一部分病灶位于前列腺窝以外[20]。对于评估局部复发病灶来说,联合使用68Ga-PSMA PET和MRI相比单纯68Ga-PSMA PET检查,可提高对局部复发的检出率[21]。一项探讨PSMA PET/CT对根治术后BCR患者挽救性放疗后无BCR生存率影响的前瞻性研究结果显示,PSMA PET/CT检查可改变1/3的BCR患者挽救性放疗的方案[22]。 专家推荐:①推荐BCR患者使用PSMA PET/CT检查评估转移情况。②采用68Ga或18F标记的PSMA PET/CT检查均是可行的,根据可获得性选择。 3.挽救性放疗的应用 (1)适应证和治疗时机 对于根治性前列腺切除术后BCR患者,早期挽救性放疗仍有机会治愈肿瘤,可降低后续内分泌治疗失败的风险。3项前瞻性随机对照试验对比了早期挽救性放疗与术后辅助放疗。2023年RADICALS-RT研究[10]最新结果显示,中位随访时间8年,辅助放疗组和早期挽救性放疗组的长期无远处转移生存和OS差异无统计学意义,但辅助放疗增加了泌尿系统和肠道不良反应的发生率。在RAVES研究[8]中,中位随访时间6.1年,辅助放疗组和早期挽救性放疗组的无生化进展率差异无统计学意义,而早期挽救性放疗组≤2级泌尿生殖系统不良反应发生率低于辅助放疗组。GETUG-AFU-17研究[9]中,中位随访时间6.25年,辅助放疗组和早期挽救性放疗组的5年无事件生存率差异无统计学意义,辅助放疗相比早期挽救性放疗会增加泌尿生殖系统毒性和勃起功能障碍的风险。综上所述,推荐对根治性前列腺切除术后BCR患者,使用早期挽救性放疗,而不是辅助放疗。 (2)治疗靶区 针对根治性前列腺切除术后的放疗,尽管有各种前列腺床轮廓的共识[23-27],但尚未统一。SPPORT研究[6]结果显示,在RTOG共识[23]定义的前列腺床范围基础上,增加盆腔淋巴区的放疗,相比单纯前列腺床放疗的无进展生存率更优,但不良反应发生率也相对更高。另一项研究结果也同样证实增加盆腔淋巴结放疗能降低生化进展风险[28]。ESTRO-ACROP共识[29]提出了关于放疗范围下界、前界、后界、侧界的具体内容。 (3)剂量与毒性 最佳挽救性放疗剂量尚未明确,建议术后挽救性放疗剂量为64~72 Gy(常规分割)。若影像学或组织活检明确病灶位置,应局部增加剂量。一项汇总了10个中心数据的研究结果显示,≥66.0 Gy的挽救性放疗剂量与生化失败的累积发生率降低相关[30]。一纳入71项研究的系统回顾中,肿瘤的中位控制剂量(TCD50)为65.8 Gy,70 Gy、60 Gy的无复发生存率分别为58.4%、38.5%,每Gy可使无复发生存改善2.0%(95%CI 1.1~3.2)[31]。在3项重要的RCT中,接受的剂量为64.8~70.2Gy[30,32-33]。我国一项研究结果显示针对高危患者(Gleason评分8~10分),72 Gy组的无生化进展率优于66 Gy组[34],两组后期消化/泌尿系统2级不良反应比较差异无统计学意义,均未发生3级不良反应。 在一项关于挽救性放疗剂量递增的研究中,64 Gy组和70 Gy组的急性2级、3级泌尿系统不良反应发生率分别为13.0%和16.6%、0.6%和1.7%,胃肠道2级、3级不良反应发生率分别为16.0%和15.4%、0.6% 和2.3%[35-36]。随着剂量的增加,远期2级和3级胃肠道毒性显著增加,但生活质量无显著差异。 (4)挽救性放疗联合ADT治疗的价值以及ADT治疗时长的推荐 在挽救性放疗中联合使用ADT能够进一步改善患者的生存,特别是接受挽救性放疗前PSA较高、术后切缘阳性、ISUP分级较高的患者,应联合ADT治疗。ADT的使用时长目前尚无定论。BCR高危患者更能获益于ADT治疗。 RTOG 9601研究[33]中位随访13年,相比单独挽救性放疗,挽救性放疗联合2年比卡鲁胺治疗可显著提高长期OS率,降低转移性前列腺癌发病率和病死率。GETUG-AFU 16研究[4]中位随访10年,与单独挽救性放疗相比,挽救性放疗联合6个月戈舍瑞林治疗可显著改善BCR、生化无进展生存期(progression free survival,PSF)和适度的无转移生存期(metastasis free survival,MFS)。RTOG 0534研究[6]中位随访8.2年,单纯挽救性放疗组的5年OS率为70.9%,RT+4~6个月ADT组为81.3%,挽救性放疗+盆腔淋巴结挽救性放疗+4~6个月ADT组为87.4%,组间差异有统计学意义。 上述3项研究结果显示,在中高危BCR患者中,使用挽救性放疗+ADT相比单纯挽救性放疗,能够显著改善MFS。GETUG-AFU-16研究[4]、RTOG 0534研究[6]均使用短程ADT(<6个月),SPPORT研究[6]使用短程ADT(6个月),均未见OS获益。仅RTOG 9601研究[33]中,挽救性放疗+2年抗雄激素药物治疗显示出显著的OS获益。RADICALS-HD研究[37]结果显示,对于接受术后放疗的患者,2年ADT较6个月ADT可以获得更长时间的无远处转移生存和OS。 一项针对ADT与挽救性放疗联合获益的系统综述[38]结果显示,ADT的OS获益仅限于随访时间延长至≥10年,挽救性放疗前PSA≥0.7 ng/ml,或存在较高的Gleason分级或切缘阳性的患者,建议根据挽救性放疗前PSA(<0.5,0.6~1.0,>1.0 ng/ml)、切缘状态和ISUP分级对患者进行风险分层,进行个体化治疗。 专家推荐:①BCR后挽救性放疗与术后辅助放疗的生存时间无差异,但生活质量提高;②在没有ADT治疗的前提下,对于BCR患者建议尽早开始挽救性放疗;③挽救性放疗区域不仅包括前列腺窝,还要覆盖盆腔淋巴引流区;④挽救性放疗的推荐剂量为64~72 Gy;⑤推荐挽救性放疗需要联合ADT,首选长程ADT。 4.挽救性淋巴结清扫术的应用 随着PSMA PET/CT等高精度影像学技术的进步,对于前列腺癌BCR后局部或寡转移性复发的精确诊断变得可行,挽救性淋巴结清扫术(salvage lymph node dissection,SLND)因此在临床中的应用受到更多关注。这种手术旨在切除淋巴结内的复发性病灶,以延迟全身治疗的需求,期望通过局部控制来改善患者的长期生存率和无复发生存率。 (1)SLND ①手术适应证:SLND主要适用于根治性前列腺切除术后出现BCR的患者,尤其是当PSMA PET/CT检查确认复发灶局限于盆腔或腹膜后淋巴结时。Suardi等[39]的研究结果显示,接受SLND的患者5年总生存率为73%,无疾病生存率为52%,突显了此项手术对于精确选定患者的潜在长期获益。Bravi等[40]分析指出,尽管SLND早期结果表现积极,但长期随访发现一些患者的远期疗效并不如预期。 ②手术范围:手术范围应根据PSMA PET/CT或类似的高精度影像技术的结果来确定,目的是清除所有可疑的转移淋巴结。Knipper等[41]的研究通过PSMA核素引导手术(PSMA-radioguided surgery,PSMA-RGS)技术,在94%的患者中成功移除了复发病灶,其中60%的患者术后实现了完全生化响应(PSA<0.2 ng/ml)。因为该领域缺乏前瞻性随机对照研究,所以以下问题仍然悬而未决:当病灶位于一侧盆腔时,是否要行双侧盆腔淋巴结清扫术;当病灶仅位于盆腔时,是否要行腹膜后淋巴结清扫术。 ③手术技巧:SLND要求外科医生具有高度专业的技能和对盆腔解剖的深刻理解。Knipper等[41]的研究强调了PSMA-RGS技术在提高手术准确性和成功率方面的价值,显示了高达95%的病灶检出率和低至6.6%的高级别并发症发生率。 ④相关并发症:SLND可能导致的并发症包括淋巴漏和血栓形成。尽管使用PSMA-RGS技术进行SLND可以减少并发症的风险,但术前医生应向患者告知可能的风险。 (2)SLND术后的辅助治疗 根据手术结果和PSA变化情况,一些患者可能需要辅助治疗,包括激素疗法或放疗,以进一步控制疾病。这一决策应依据个体患者的具体情况,考虑病理评估、手术结果和PSMA PET/CT复查结果,以提供最适合每例患者的后续治疗方案。 专家推荐:仅建议在临床研究的形式下开展BCR后SLND。 5.全身系统性治疗的应用 由于缺乏高质量的多中心临床研究,目前仍然无法确定单独使用ADT在根治术后BCR患者中是否会带来生存获益。因此,国内外临床诊疗指南并未推荐单独使用ADT来治疗术后BCR患者。然而,近年来国际多中心临床研究结果显示,ADT联合挽救性放疗可显著改善BCR患者的总体预后。sGETUG-AFU 16研究[42]是一项国际多中心Ⅲ期随机对照临床研究,针对术后BCR患者进行挽救性放疗联合6个月促黄体激素释放激素激动剂的联合治疗,结果显示联合治疗可有效提升15%的10年疾病无进展生存率,并降低46%的疾病进展风险。NRG Oncology/ RTOG 0534 SPPORT研究[32]结果也证实短程ADT联合挽救性放疗可有效改善患者的PFS和MFS。 新型雄激素信号通路抑制剂(ARPI)是目前晚期前列腺癌患者使用最广泛的治疗药物之一,ADT与其联合的治疗方案可有效延长患者的预后生存。近期的研究结果表明,ADT联合ARPI在根治术后BCR高危患者中同样具有潜在的应用价值。例如,EMBARK研究[14]是一项国际多中心随机对照临床研究,将术后具有高危因素(PSA-DT≤9个月)的BCR患者随机分为3组,分别接受ADT联合恩扎卢胺、单纯ADT、单纯恩扎卢胺治疗,结果显示相较于单纯ADT,ADT联合恩扎卢胺可显著提升5年无转移生存率(87.3%与71.4%),降低了58%的转移发生风险;即使恩扎卢胺单药治疗也可显著降低39%、38%、58%的远处转移、临床症状出现、骨痛症状出现的风险。类似的ADT联合ARPI治疗的研究还包括ARASTEP研究[43],聚焦于ADT和达罗他胺的联合治疗,该研究中期结果显示,联合治疗可有效改善rPFS和MFS。此外,ADT联合两种ARPI也被证实可改善远期生存预后。PRESTO研究[44]比较了单纯ADT与ADT联合阿帕他胺(二联),以及ADT联合阿帕他胺和阿比特龙(三联)的疗效。结果显示在确保治疗安全性的前提下,二联和三联治疗方案可分别延长4.6个月和5.7个月的无PSA进展生存时间,降低了48%和52%的PSA进展风险,显著改善患者预后。 综上所述,以ADT为基础的全身系统性治疗,联合局部挽救性放疗或新型ARPI的治疗方案被证实能有效延长术后BCR高危患者的疾病进展,使患者生存获益。然而,首选治疗方案、序贯治疗选择、ARPI联合挽救性放疗是否有效等问题仍亟待未来更多大型临床研究来解答。 6.治疗后的随访与评估 BCR高危患者在治疗后更需要严密的随访。临床上应根据患者疾病分期、临床症状、预后评估及所选择的治疗方案如挽救性放疗、挽救性淋巴结清扫、ADT+新型雄激素信号通路抑制剂来指定个体化随访方案。 (1)血清PSA监测 PSA检查是BCR高危患者治疗后随访监测的主要指标。推荐在开始挽救性治疗后第3、6个月进行初步PSA随访评估。对于治疗反应良好者,如无临床症状、心理状况良好、治疗依从性好、PSA水平<4 ng/ml,可每6个月随访1次。 (2)血清睾酮监测 接受药物去势的患者,有必要定期监测血清睾酮水平。理想的血清睾酮去势水平应<50 ng/dl。推荐使用促黄体激素释放激素激动剂药物去势后1个月复查血清睾酮,6个月后复查睾酮进一步明确是否达到稳定的去势状态。 (3)影像学评估 由于BCR患者进展至临床转移需7~8年,PSA<7 ng/ml时,骨扫描和腹部/盆腔CT阳性率很低(<5%),因此对于联合ADT治疗后PSA没有升高趋势的无症状患者,不推荐常规的影像学检查[16]。 (4)放疗及药物不良反应的随访与评估 采用ADT+新型ARPI作为BCR高危患者系统治疗方案,应根据药物特有的不良反应制订相应的随访策略。ADT+新型ARPI的常见不良反应包括疲乏、潮热、高血压等。推荐所有患者在接受系统治疗后,每3个月定期监测血压、肝肾功能。 (5)代谢并发症的监测 前列腺癌ADT治疗后由于睾酮水平的显著降低可能会出现一系列代谢相关并发症如糖尿病、心血管相关事件、脆性骨折等[45-46]。推荐患者在接受ADT治疗后每3个月进行空腹血糖和糖化血红蛋白检测。ADT治疗后每2年进行骨骼检测,同时监测血清维生素D和钙浓度。 (6)生活质量和心理学评估及监测 患者接受ADT治疗后可出现抑郁、紧张、焦虑等精神改变,甚至出现认知障碍;也可能出现性欲下降、勃起功能障碍、贫血、体质量增加等,严重时可影响生活质量。推荐采用体能评估、焦虑状态评估、生活质量评分等量表进行评估。 戴波、刘皓、范宇、陈守臻、叶华茂、徐子程 参与讨论和审定专家(按单位汉语拼音排序): 安徽医科大学第一附属医院(梁朝朝),北京大学第一医院(范宇、何志嵩),重庆大学附属肿瘤医院(刘南),重庆医科大学附属第一医院(苟欣),复旦大学附属肿瘤医院(万方宁、戴波、叶定伟),福建医科大学附属协和医院(朱绍兴),广西医科大学附属肿瘤医院(蒙清贵),贵州医科大学附属医院(谷江),哈尔滨医科大学附属第二医院(徐万海),河北医科大学第四医院(张爱莉),湖北省肿瘤医院(魏少忠),华中科技大学同济医学院附属同济医院(胡志全),吉林大学第一医院(王春喜),江苏省肿瘤医院(徐子程、邹青),江西省肿瘤医院(涂新华),解放军总医院(王保军),兰州大学第二医院(岳中瑾),辽宁省肿瘤医院(胡滨),山东大学齐鲁医院(陈守臻、史本康),山东第一医科大学附属肿瘤医院(边家盛),山西省肿瘤医院(陈惠庆),上海长海医院(叶华茂、高旭),四川大学华西医院(魏强),四川省肿瘤医院(廖洪),天津医科大学总医院(牛远杰),西安交通大学第二附属医院(种铁),西安交通大学第一附属医院(李磊),厦门大学附属第一医院(邢金春),新疆维吾尔自治区肿瘤医院(陈鹏),云南省肿瘤医院(王启林),浙江大学医学院附属第一医院(金百冶),郑州大学第一附属医院(张雪培),中南大学湘雅医院(齐琳),中山大学孙逸仙纪念医院(刘皓、林天歆),中山大学肿瘤防治中心(周芳坚)